
پتاسیم کلرات به عنوان یک جامد کریستالی سفید ظاهر می شود. این ماده جزء مواد منفجره، آتش بازی، بوده است. این ترکیب خاصیت ضدعفونی کنندگی نیز دارد. پتاسیم کلرات به عنوان یک اکسید کننده قوی شناخته می شود. در تولید اکسیژن می توان از این ماده استفاده کرد. رنگ بنفش شعله های آتش به علت حضور این ماده است.
پتاسیم کلرات | خرید پتاسیم کلرات | فروش پتاسیم کلرات | قیمت پتاسیم کلرات
پتاسیم کلرات با فرمول شیمیایی KClO۳یک ترکیب بلوری بی رنگ است، که در آب محلول است و در اتانول نسبتاً محلول است. پتاسیم کلرات به صورت محلول آبی، به عنوان یک مایع بی رنگ ظاهر می شود. این ماده چگال تر از آب است.
این ترکیب در دمای ۳۵۷ درجه سانتی گراد ذوب می شود و با تکامل سریع اکسیژن در ۴۰۰ درجه سانتیگراد تجزیه می شود. بی بو است اما طعم کمی شور دارد. وزن مخصوص آن ۲.۳۳۷ است.
به نظر می رسد که مادهhygroscopic (گیرنده رطوبت) نیست، اما در آب محلول است. این ماده رنگ بنفش را به ترکیب شعله های آتش اضافه می کند.کلرید پتاسیم (KClO3) یک ماده اکسید کننده قوی است که کاربردهای متنوعی دارد.
به عنوان یک دانش آموز شیمی دبیرستانی یا کالج شیمی، ممکن است شما از آن برای تولید اکسیژن در آزمایشگاه استفاده کرده باشید.
کاربرد های پتاسیم کلراید
کلرید پتاسیم یک ترکیب مهم است که به طور گسترده در زمینه های مختلف از جمله صنایع شیمیایی، کشاورزی، دارو و غیره مورد استفاده قرار می گیرد. این ماده یکی از اولین مؤلفه هایی است که به دلیل ماهیت انفجاری در محل تولید آتش بازی ها به کار می رود و در آن جا به عنوان اکسید کننده عمل می کند، که نقش مهمی در سوزاندن ترقه ها با سرعت سریع، بازی می کند.
خاصیت اکسید کننده پتاسیم کلرات، آن را به یک جزء ترکیبی در دود، برای تولید دود نارنجک تبدیل می کند. پتاسیم کلرات علاوه بر موارد انفجاری، همچنین خاصیت ماده ضد عفونی کننده را نشان می دهد، که معمولاً برای تهیه دی اکسید کلر استفاده می شود. از پتاسیم کلرات می توان در پزشکی برای درمان ذات الریه و همچنین مسمومیت با گاز استفاده کرد.
پتاسیم کلراید یک ماده ضد عفونی کننده مؤثر است که اغلب برای از بین بردن باکتری ها، ویروس ها، تک یاخته ها و ترکیبات بو دار استفاده می شود. همچنین در صنایع شیمیایی به عنوان به عنوان محرک آکاردیاک در دارو و همچنین خمیردندان کاربرد دارد.
علاوه بر این، در آزمایشگاه، کلرید پتاسیم را می توان به اکسیژن تجزیه کرد که منبع بسیار ارزان قیمت تر اکسیژن در مقایسه با تانک اکسیژن تحت فشار یا کرایوژنیک است.برای تهیه کبریت، کاغذ نیز از پتاسیم کلرات استفاده می شود.
و به عنوان سیستم تأمین اکسیژن هواپیماها، ایستگاه های فضایی، زیردریایی ها نیز مورد استفاده قرار می گیرد. مطالعات نشان داده اند که کلرید پتاسیم در پرورش درخت خفته، مفید است. به عنوان مثال درختان Longan برای افزایش عملکرد هنگام میوه دهی، با کلرید پتاسیم درمان می شوند.
پتاسیم کلرات در چاپ و رنگرزی پنبه و پشم سیاه، ساخت آنیلین سیاه و رنگهای دیگر ودر آنالیزهای شیمیایی مورد استفاده قرار می گیرد.
خصوصیات فیزیکی و شیمیایی پتاسیم کلرات
|
۳۵۶ °C(lit.)
|
Melting point
|
|
۴۰۰°C
|
Boiling point
|
|
۲,۳۲ g/cm۳
|
Density
|
|
۲-۸°C
|
storage temp.
|
|
Powder/Solid
|
form
|
|
۲.۳۲
|
Specific Gravity
|
|
White
|
color
|
|
۵.۶ (۷۳g/l, H2O, 20°C)
|
PH
|
|
۷۳ g/L (20 ºC)
|
Water Solubility
|
|
Hygroscopic
|
Sensitive
|
|
Stability Strong oxidizer – contact with combustible material may cause fire. Mixtures with combustible material may be shock-sensitive. Incompatible with organics, combustible materials, strong reducing agents.
|
Stability
|
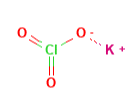 |
Structure |
 |
Chemical Safety |
| ClKO۳ or KClO۳ | Molecular formula |
|
POTASSIUM CHLORATE3811-04-9 Fekabit Potcrate Kaliumchlorat |
Synonyms |
| ۱۲۲.۵۵ g/mol | Molecular weight |
نکات ایمنی در مورد پتاسیم کلرات
کلرات های فلزی در حضور اسید قوی اکسیدان هستند. گاز دی اکسید کلر انفجاری را آزاد می کند. دی اکسید کلر و دی اکسید کربن را با گرم کردن کلر فلز مرطوب کلرات و یک اسید آلی دی بازیک آزاد می کند. مخلوط پرکلرات ها با گوگرد یا فسفر به صورت انفجاری است.
از آنجا که یک اکسید کننده قوی است، KClO3 باید از تماس با مواد آلی خودداری شود. پتاسیم کلرات، معدنی مانند گوگرد عنصری، فسفر، ید و اسیدهای غلیظ را احیا می کند.
مخلوط بسیار قابل اشتعال را با مواد قابل احتراق تشکیل می دهد. اگر مواد قابل احتراق بسیار ریز تقسیم شوند ممکن است مخلوط مواد منفجره باشد. مخلوط حاوی پتاسیم کلرات ممکن است توسط اصطکاک مشتعل شود.
تماس با اسید سولفوریک قوی ممکن است باعث آتش سوزی یا انفجار شود. ممکن است در صورت مخلوط شدن با نمک های آمونیوم به طور خود به خود تجزیه و مشتعل شود. ممکن است در اثر قرار گرفتن طولانی مدت در معرض گرما یا آتش منفجر شود.
تماس با پتاسیم کلرات ممکن است پوست، چشم و غشاهای مخاطی را تحریک کند و همچنین ممکن است در اثر بلع سمی باشد.
منابع :
https://www.chemicalbook.com/ChemicalProductProperty_EN_CB7853577.htm
https://www.acs.org/content/acs/en/molecule-of-the-week/archive/p/potassium-chlorate.html
https://pubchem.ncbi.nlm.nih.gov/compound/Potassium-chlorate

 شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره
شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره